|
¿Cómo son los átomos por dentro?
7 sesiones
|
A.1.
Ejercicio 1.2.4. Anota en tu libreta todo lo que recuerdes acerca de:
a) la teoría atómico-molecular de la materia
b) El átomo y las partículas subatómicas (dibújalo)
c) Número atómico y número másico
d) Isotopos e iones.
A.2. Elabora un texto con la corrección del
ejercicio anterior.
A.3. Asocia
cada uno de estas ideas con una teoría atómica:
a) La materia está formada por partículas.
b) Los distintos elementos químicos están formados
por átomos diferentes.
c) La estructura atómica es la responsable de que
la materia tenga carga eléctrica.
A.4. Verdadero
o falso: “Los cuerpos neutros no tienen cargas eléctricas”
A.5.
Dibuja de acuerdo con las ideas de Thomson, el átomo de hidrógeno (que tiene un
solo electrón).
A.6. ¿En
qué consistía el experimento de Rutherford?
A.7. ¿Qué
resultado sería lógico obtener, si los átomos fueran como Thomson suponía?
¿Por qué Rutherford pensó que el átomo estaba
prácticamente hueco?
A.8. Indica toda la información contenida en
ELEMENTO
SÍMBOLO
A
Z
Electrones
Protones
Neutrones
Carbono
12
6
6

Hierro
26
26
30
Plata
47
47
61
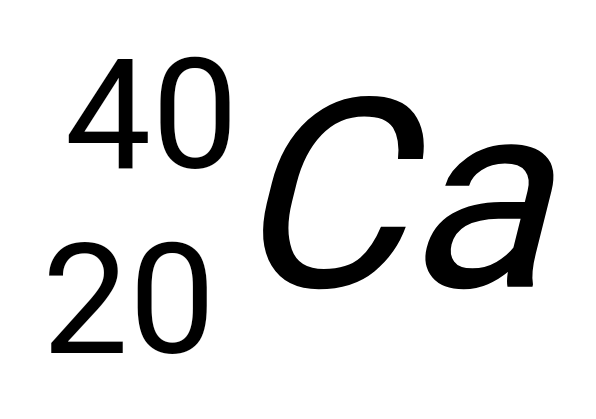
Carbono
14

Sodio
23
11
11
ELEMENTO
|
SÍMBOLO
|
A
|
Z
|
Electrones
|
Protones
|
Neutrones
|
Carbono
|
12
|
6
|
6
| |||
Hierro
|
26
|
26
|
30
| |||
Plata
|
47
|
47
|
61
| |||
Carbono
|
14
| |||||
Sodio
|
23
|
11
|
11
|
4.3. Iones
A.11. Para comprobar la
intuición de que las propiedades están relacionadas con la estructura
electrónica de los átomos, se requiere hacer lo mismo con varios elementos de
una misma columna del Sistema Periódico para hallar su distribución
electrónica. En base a estos resultados y analizando la tabla periódica de elementos:
a) Determina la distribución electrónica de los
elementos Li, Na y K ¿Qué tienen en común de los elementos del primer grupo?
b) ¿En qué residirá la semejanza de los elementos
del segundo grupo del Sistema Periódico? Verifica estableciendo las distribuciones
electrónicas del Be, Ca y Mg.
c) Justifica la semejanza de propiedades químicas
en los casos de N y P; O y S; F y Cl.
d) Indica cuál es la característica común, desde el
punto de vista de la distribución electrónica, de los gases nobles He, Ne y Ar.
Relaciona este hecho con la principal característica que da nombre al grupo.
A.12. Dibuja un átomo de
litio y un catión de litio que ha perdido un electrón, calcula su carga.
A.13. Dibuja un átomo de
oxígeno y un anión de oxígeno que ha ganado dos electrones, calcula su carga.
A.14. Completa la tabla:

