|
¿Cómo es la materia por dentro?
¿Cómo se explican las distintas propiedades de los materiales?
|
2.1. La materia
La materia es todo aquello que tiene masa y
ocupa un volumen
ocupa un volumen
2.1.1. Propiedades generales y específicas
de la materia
de la materia
Se llaman propiedades específicas o características a aquellas
que nos permiten diferenciar una sustancia de otra,
como por ejemplo el color.
Puesto que toda la materia está formada por
átomos, su estructura interna es
prácticamente igual y esto hace que haya
propiedades comunes a todas las sustancias,
como por ejemplo la masa y el volumen. Se llaman propiedades generales.
A1. Ejercicio 1.2.4. Elabora una lista con propiedades
específicas de las sustancias
específicas de las sustancias
A.2. Elabora una lista con propiedades generales.
2.1.2. Propiedades intensivas y extensivas
de la materia.
de la materia.
Por otro lado, también podemos clasificar las
propiedades en:
propiedades en:
A) extensivas: aquellas que dependen de la
cantidad de materia que midamos, como la
masa.
cantidad de materia que midamos, como la
masa.
B) intensivas: aquellas que no dependen de la
cantidad de materia que consideremos,
cómo el color.
cantidad de materia que consideremos,
cómo el color.
A.3. Ejercicio 1.2.4. Elabora una lista con
propiedades intensivas de la materia.
propiedades intensivas de la materia.
A.4. Completa la tabla como en el ejemplo:
Específica o general
|
Intensiva o extensiva
|
Cualitativa o cuantitativa
| |
Color
|
Específica
|
Intensiva
|
Cualitativa
|
Temperatura
| |||
Masa
| |||
Volumen
| |||
Longitud
| |||
Densidad
| |||
Brillo
| |||
Velocidad
|
2.2. Masa, peso, volumen y densidad.
Sabemos que las sustancias tienen una cantidad de materia determinada
(decimos que tiene masa), que pesa (se ve atraída hacia la superficie de la Tierra)
y que ocupa un “espacio” (tiene volumen).
La relación entre la masa y el volumen depende de lo separados que estén sus
átomos y de la masa atómica de estos, por eso, la densidad es una propiedad
específica de la materia que podemos calcular al aplicar la fórmula: d=m/V
En los materiales muy densos la masa está muy concentrada, mientras que
en los materiales de baja densidad, poca masa ocupa mucho volumen,
esto puede deberse a que la componen átomos más ligeros, o a que haya
más espacio entre los átomos..
Cómo hemos visto la masa de cualquier objeto
es una propiedad que, en principio, nos indica
la cantidad de materia que tiene dicho
objeto.
es una propiedad que, en principio, nos indica
la cantidad de materia que tiene dicho
objeto.
Cuando decimos que un cuerpo pesa,
nos imaginamos que tenemos que hacer una
fuerza para
sostenerlo (tanto mayor cuanto más pese).
nos imaginamos que tenemos que hacer una
fuerza para
sostenerlo (tanto mayor cuanto más pese).
El científico inglés Newton demostró que la
materia ordinaria tiene una propiedad tal que,
dos trozos cualesquiera de materia ejercen
siempre entre ellos una fuerza de atracción.
materia ordinaria tiene una propiedad tal que,
dos trozos cualesquiera de materia ejercen
siempre entre ellos una fuerza de atracción.
El valor de dicha fuerza depende de la
distancia entre las masas (a más distancia
menos fuerza)
y de la masa de cada uno (cuánto mayor
es la masa, mayor es la fuerza).
distancia entre las masas (a más distancia
menos fuerza)
y de la masa de cada uno (cuánto mayor
es la masa, mayor es la fuerza).
De esta forma, cuando decimos “el peso”
nos referimos a la fuerza gravitatoria con
que la Tierra atrae a cualquier cuerpo
que se encuentre sobre ella, y, aunque
está relacionada con
la masa, no es lo mismo. La masa es la
cantidad de materia y el peso es la fuerza
de la gravedad.
nos referimos a la fuerza gravitatoria con
que la Tierra atrae a cualquier cuerpo
que se encuentre sobre ella, y, aunque
está relacionada con
la masa, no es lo mismo. La masa es la
cantidad de materia y el peso es la fuerza
de la gravedad.
A.5. Sometemos a un mismo trozo de hierro a los siguientes procesos:
a) Calentarlo hasta que se haga totalmente líquido
b) Pulverizarlo
c) Colocarlo en órbita en el espacio
d) Partirlo en dos pedazos iguales y dejar sólo
uno de ellos.
uno de ellos.
e) Llevarlo a la Luna
¿En cuál o cuáles de los anteriores procesos
variará su masa?
variará su masa?
A.6. Señala si las siguientes proposiciones
son verdaderas (V) o falsas (F), explicando
por qué.
son verdaderas (V) o falsas (F), explicando
por qué.
a) 1 kg de plomo pesa más que 1 kg de paja
b) El peso se mide en kg
c) En el vacío los cuerpos no pesan.
d) Dentro del agua se pesa menos que fuera
a)F ya que 1 kg de masa siempre es 1 kg de
masa, sin importar que se trate de plomo o
de paja. Lo que ocurre es que, si es de plomo
(como este es más denso) tendrá mucho
menos volumen.
Y puesto que el peso solo depende de la masa
y de la distancia a la Tierra, pesarán lo mismo.
masa, sin importar que se trate de plomo o
de paja. Lo que ocurre es que, si es de plomo
(como este es más denso) tendrá mucho
menos volumen.
Y puesto que el peso solo depende de la masa
y de la distancia a la Tierra, pesarán lo mismo.
b)F El peso no es lo mismo que la masa
(aunque estén relacionados): el peso es una
fuerza (se mide en N) y la masa es la cantidad
de materia (se mide en kg).
(aunque estén relacionados): el peso es una
fuerza (se mide en N) y la masa es la cantidad
de materia (se mide en kg).
c) La fuerza gravitatoria no depende del
medio en el que se mida, da igual que
estemos en el vacío o no. Un astronauta que
ya ha dejado la atmósfera y se aleja de la
Tierra en su nave, sigue
siendo atraído por la Tierra, sólo que cada
vez con menos fuerza porque está más lejos.
Cada vez pesaría menos, y sin embargo,
seguiría teniendo la misma masa,
aunque se encuentre en
el vacío,
medio en el que se mida, da igual que
estemos en el vacío o no. Un astronauta que
ya ha dejado la atmósfera y se aleja de la
Tierra en su nave, sigue
siendo atraído por la Tierra, sólo que cada
vez con menos fuerza porque está más lejos.
Cada vez pesaría menos, y sin embargo,
seguiría teniendo la misma masa,
aunque se encuentre en
el vacío,
De hecho, el Sol y los planetas que le rodean
se atraen gravitatoriamente y están en el
“vacío”.
se atraen gravitatoriamente y están en el
“vacío”.
d) Finalmente, el peso de un cuerpo es la
fuerza con que la Tierra lo atrae y da igual
que esté o no dentro del agua. Lo que ocurre
es que, en el agua, además del peso (que nos
empuja hacia abajo)
existe otra fuerza, que se llama empuje,
que hace que los objetos menos densos floten
por encima de los de mayor densidad.
fuerza con que la Tierra lo atrae y da igual
que esté o no dentro del agua. Lo que ocurre
es que, en el agua, además del peso (que nos
empuja hacia abajo)
existe otra fuerza, que se llama empuje,
que hace que los objetos menos densos floten
por encima de los de mayor densidad.
PRÁCTICAS DE LABORATORIO: LA DENSIDAD
2.3.La teoría cinético-molecular
Lectura página 36
A.12. Elabora una hipótesis para explicar por qué
los gases:
los gases:
a) Se pueden comprimir tanto (compresibilidad).
b) Presionan las paredes del recipiente en el
que se encuentren
que se encuentren
c) Al calentarlos se dilatan (o enfriarlos,
se contraen).
se contraen).
d) Al calentarse aumenta la presión sobre
las paredes del recipiente en el que se encuentren
las paredes del recipiente en el que se encuentren
A.13. Elabora una hipótesis para explicar
cómo funciona un termómetro de mercurio.
cómo funciona un termómetro de mercurio.
a) Se pueden comprimir tanto (compresibilidad).
En los gases los huecos entre las partículas son
muy grandes al estar poco atraídas unas por
otras, por lo que es lógico pensar que los gases
se puedan comprimir mucho. Al presionar las
partículas pueden acercarse una a otras y, sin
embargo, aunque los huecos disminuyan, las
partículase seguirán estando alejadas.
muy grandes al estar poco atraídas unas por
otras, por lo que es lógico pensar que los gases
se puedan comprimir mucho. Al presionar las
partículas pueden acercarse una a otras y, sin
embargo, aunque los huecos disminuyan, las
partículase seguirán estando alejadas.
b) Presionan las paredes del recipiente en el
que se encuentren
que se encuentren
Análogamente, al haber muchísimas partículas
moviéndose en todas direcciones, se
producirán cada
moviéndose en todas direcciones, se
producirán cada
segundo millones y millones de choques
de esas partículas contra todas las paredes
internas del
de esas partículas contra todas las paredes
internas del
recipiente, lo que justifica la presión ejercida
por el gas sobre ellas.
por el gas sobre ellas.
c )Al calentarlos se dilatan, o enfriarlos,
se contraen.
se contraen.
Al aumentar la temperatura se aumenta
volumen, esto se puede explicar por el
aumento que se
volumen, esto se puede explicar por el
aumento que se
produce en la velocidad con que se mueven
las partículas, si las partículas se mueven más
rápido
las partículas, si las partículas se mueven más
rápido
tendrán más energía y se alejarán mucho más
unas de otras. Si el hueco entre las partículas
es mayor,
unas de otras. Si el hueco entre las partículas
es mayor,
ocuparán un volumen mayor
(y al contrario al disminuir la temperatura).
(y al contrario al disminuir la temperatura).
Es importante aclarar que las partículas que
forman un gas no sufren dilataciones
ni compresiones,
forman un gas no sufren dilataciones
ni compresiones,
se trata de corpúsculos prácticamente
puntuales. La masa y el tamaño no cambian,
lo que varía
puntuales. La masa y el tamaño no cambian,
lo que varía
es el espacio entre las partículas.
d) Al calentarlos aumenta la presión sobre
las paredes del recipiente en el que se
encuentren
las paredes del recipiente en el que se
encuentren
Cuánto más aumente la temperatura,
más rápido se moverán las partículas,
y por lo tanto, mayor
más rápido se moverán las partículas,
y por lo tanto, mayor
será el número de choques contra las paredes
del recipiente, generando una mayor presión.
del recipiente, generando una mayor presión.
A13 RESPUESTA: En los líquidos el efecto de la dilatación es
mucho mayor que en los sólidos, por eso,
cuando
mucho mayor que en los sólidos, por eso,
cuando
el mercurio en el interior del termómetro
recibe calor, éste experimenta una dilatación
que hace
recibe calor, éste experimenta una dilatación
que hace
que recorra el tubo del termómetro en el que
está contenido. Así, cuando el mercurio
atraviesa la escala numérica, podemos medir la
temperatura.
está contenido. Así, cuando el mercurio
atraviesa la escala numérica, podemos medir la
temperatura.
2.4. Las propiedades de los gases
Un estudiante dispone de un dinamómetro y de un globito lleno de agua. A continuación, cuelga el globito del dinamómetro y sumerge ambos totalmente en agua (barreño, bañera, piscina…). Si lo hace observará que el dinamómetro marcará:
a) Un peso menor que fuera del agua b) El mismo peso que en el aire c) Marcará cero.
Lectura páginas 37-39
Las propiedades estudiadas hasta aquí, ¿se pueden aplicar también a los gases? En concreto:
¿Tienen masa los gases? ¿Pesan? ¿Tienen volumen? ¿Se puede hablar de densidad de un gas?
a) Un peso menor que fuera del agua b) El mismo peso que en el aire c) Marcará cero.
Lectura páginas 37-39
A.14. Realiza todos los cambios de unidades de los ejercicios de la página 37
2.5. LA LEY DE BOYLE-MARIOTTE (T=cte)
A.15. A una presión de 17 atm, 25L de un gas experimenta un cambio
a temperatura constante pasando a ocupar un volumen de 15 L.
¿Cuál será la presión que ejerce al final?
A.16.Una cantidad de gas ocupa un volumen de 70 cm cúbicos a una presión de 0,78 atm. ¿Qué volumen ocupará a una presión de 1,2 atm si la temperatura no cambia?
A.17. Se tienen 55 litros de un gas sometido a
4,4 atm y de pronto se reduce esa presión a
2,4 atm, ¿Cuál será el volumen que ocupa el gas?
A.18. Un globo estalla si el volumen en su interior
supera los 5 L. Si para una presión de 1,25 atm el v
del globo es 3 litros, ¿a qué presión estallará el globo?
supera los 5 L. Si para una presión de 1,25 atm el v
del globo es 3 litros, ¿a qué presión estallará el globo?
2.6. LEY DE GAY-LUSSAC (V=cte)
A.19.u Calcula cuál será la presión de un recipiente con un gas
a 17ºC si sabemos que cuando la temperatura es de 45ºC su presión es de 2,25 atm.
A.20. La rueda de un coche contiene aire a una presión de 2,5 atm y la temperatura
es de 20ºC. Después de un largo recorrido la temperatura del aire asciende hasta 55ºC.
¿Qué presión tendrá el aire de la rueda?
A.21. Un gas se encuentra a una presión de 2 atm y a una temperatura de 27ºC.
¿Hasta que temperatura hemos de calentar el gas para que la presión se triplique?.
El volumen del gas no cambia.
A.22.A 200 K la presión que ejerce un gas es de 0,5 atm, calcula la presión que ejercerá
a 25 ºC
2.7. LEY DE CHARLES (P=cte)
A.23.. Un gas ocupa un volumen de 3.5 litros
a una temperatura de 60K. Si la presión permanece constante, ¿a qué temperatura en volumen seria
de 12 litros? A.24. Si el volumen del aire de una habitación
a 8ºC es de 900 litros. ¿Cuánto aire escapara de la
habitación si se calienta hasta 30ºC? A.25. Se encuentran 6 litros de un gas ideal a 24ºC y presión constante. ¿Cuánto disminuye su temperatura para que su volumen sea de 4 litros? A.26.Un gas que ocupaba un volumen de 1,5 litros se calienta de 298 K a 50 °C a presión constante. ¿Cuál es el nuevo volumen que ocupará?
A.27 ejer 18 pág 42
A 28 ejer 24 pág 45
A 29 ejer 25 pág 45
A 30 eje 28 pag 47
A.31 ejer 29 pág 47
A.32 ejer 51 pág 54
A.33 ejer 49 pág 54
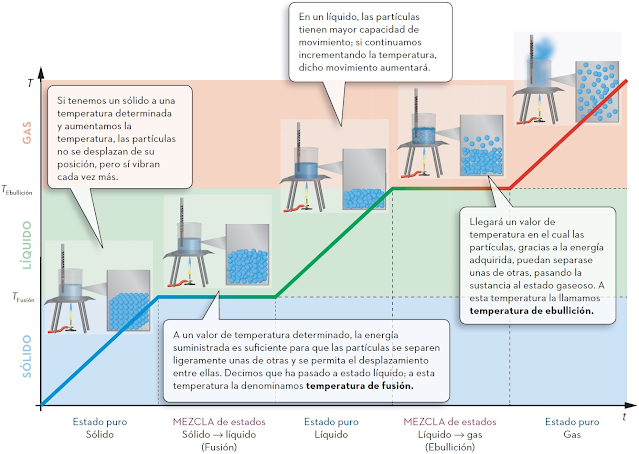
A.27. Elabora una hipótesis aplicando la teoría
cinético molecular para explicar por qué al
cinético molecular para explicar por qué al
calentar el hielo se derrite y por qué al
calentar agua líquida se obtiene vapor.
calentar agua líquida se obtiene vapor.
Si una misma sustancia (como el agua) puede
pasar de gas a líquido y/o a sólido, cabe
pensar que
las mismas partículas que forman el gas
deberán encontrarse también en el agua
líquida y en el hielo.
pasar de gas a líquido y/o a sólido, cabe
pensar que
las mismas partículas que forman el gas
deberán encontrarse también en el agua
líquida y en el hielo.
Cuando un sólido se calienta, las vibraciones
de las partículas se hacen cada vez más
intensas,
de las partículas se hacen cada vez más
intensas,
la distancia entre ellas aumenta y llega
un momento en que se generan huecos de
modo que comienza
a pasar al estado líquido (fusión).
un momento en que se generan huecos de
modo que comienza
a pasar al estado líquido (fusión).
Si se sigue elevando la temperatura,
la energía de muchas partículas puede ser
suficiente como para
escapar de la atracción de las demás,
las partículas se moverán cada vez más rápido,
la energía de muchas partículas puede ser
suficiente como para
escapar de la atracción de las demás,
las partículas se moverán cada vez más rápido,
separándose unas de otras y el líquido irá
pasando a gas (vaporización).
pasando a gas (vaporización).
En el caso contrario, el enfriamiento del gas
supone disminuir la velocidad de las
partículas hasta
supone disminuir la velocidad de las
partículas hasta
el punto de que las fuerzas atractivas ya no
sean despreciables, las partículas se acerquen cada
sean despreciables, las partículas se acerquen cada
vez más unas a otras y se unan, cambiando
a estado líquido
a estado líquido
A.28. Verdadero o falso:
- En una olla hirviendo el agua se evapora
- El punto de ebullición sólo depende de la sustancia que se vaporice.
- Cuando la ropa se seca, el agua se vaporiza.
- La evaporación se produce siempre a la misma temperatura.
- En la ebullición sólo se vaporizan las moléculas de la superficie del líquido.
- El agua que se condensa sobre las latas que sacas de la nevera sale de dentro de la lata por los poros.
A.29. Para la siguiente gráfica de calentamiento:
a) ¿Qué sucede en cada uno de los tramos?
b) Calcula el punto de ebullición y el punto de fusión de la sustancia que presenta esta gráfica de enfriamiento:.
c) ¿En qué estado se encuentra la sustancia de la gráfica anterior a 85ºC? ¿Y a 5ºC?